由于其高发病率和死亡率,癌症仍然是全世界人类健康的严重威胁,但是单药治疗通常无法达到理想的癌症治疗结果。近年来的研究表明,基于纳米药物的组合疗法可对癌症治疗发挥协同作用且减少毒副作用,已成为一个有前途的研究和治疗策略。
我校天然药物与免疫工程实验室赵美霞教授团队和中国科学院深圳先进技术研究院张卫副研究员所在团队,通过将b-环糊精-顺铂(b-CD-Pt)复合物和金刚烷基修饰的聚多巴胺纳米颗粒进行主客体超分子自组装,构建了具有光热治疗(PTT)和化疗等功能的纳米药物递送系统,不仅在细胞水平对骨肉瘤细胞表现出很强的抑制活性,而且在体内可完全消融皮下肿瘤。这项研究提出了一种创新且简便的超分子自组装策略,用于制造多功能纳米治疗体系以进行有效的联合抗癌治疗,可以进一步促进组合纳米治疗学的发展。该工作发表在国际期刊Applied Materials Today上(Fabrication of cisplatin-loaded polydopamine nanoparticles via supramolecular self-assembly for photoacoustic imaging guided chemo-photothermal cancer therapy. Appl. Mater. Today 2021, https://doi.org/10.1016/j.apmt.2021.101019IF:10.041)。河南大学为第一完成单位,天然药物与免疫工程实验室硕士研究生杜相甫为第一作者,河南大学特聘教授赵美霞为共同通讯作者。
(全文链接:https://www.sciencedirect.com/science/article/pii/S2352940721000846?via%3Dihub)
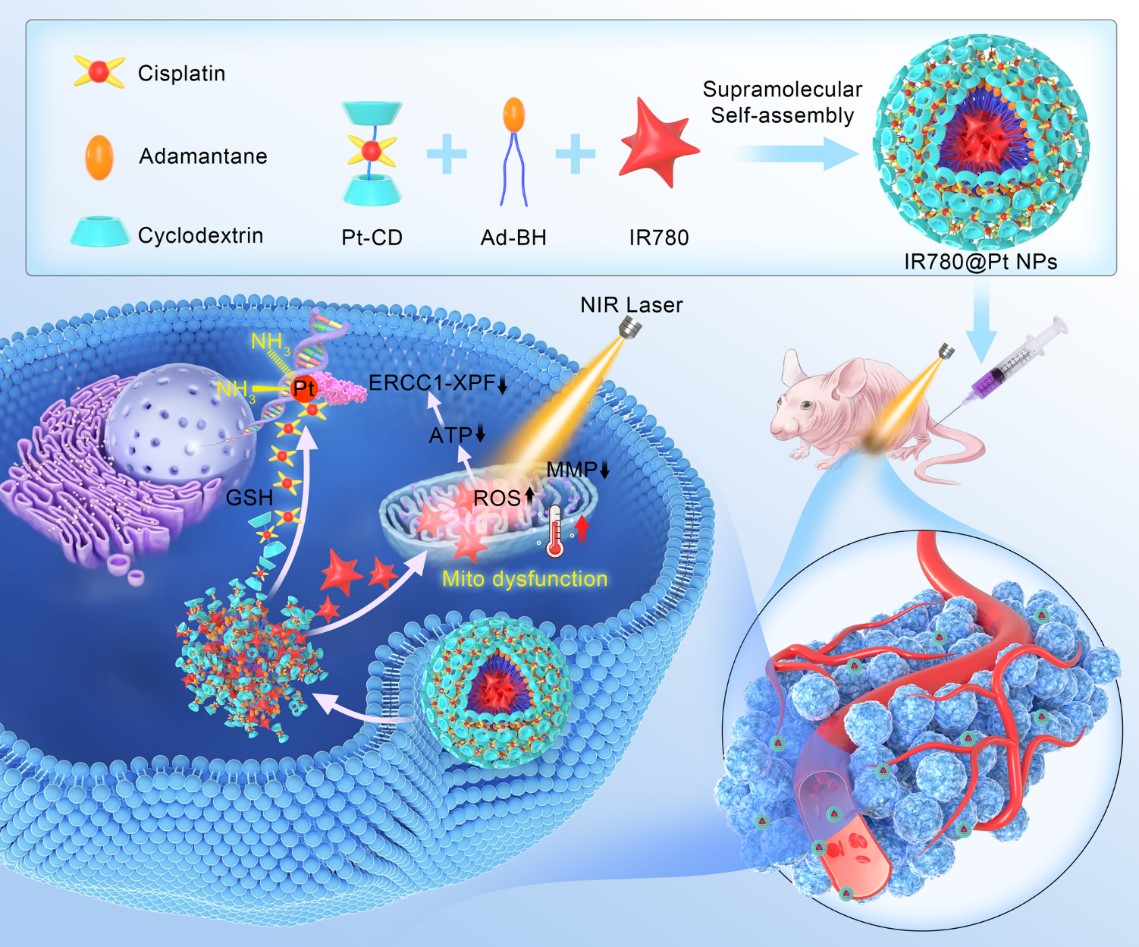
近期该合作团队在发展基于多功能纳米药物的肿瘤组合疗法上又取得重要进展。在前期工作基础上,以b-环糊精-顺铂(b-CD-Pt)复合物、金刚烷衍生物与线粒体靶向的近红外光敏剂IR780为原料,采用超分子自组装策略构建了纳米药物IR780@Pt。该纳米药物利用其良好的近红外荧光和光声成像能力,实现了体内成像引导的近红外激光治疗(光热和光动力学效应)和化疗相结合的设计目标,进一步的内在机制分析表明该类纳米药物是通过靶向性诱导线粒体功能障碍、降低DNA损伤修复而增强顺铂类化疗药物的抗肿瘤作用。本研究提出了一种创新且简便的超分子自组装策略,用于制造多功能纳米治疗体系并进行有效的联合抗癌治疗,为促进组合纳米治疗学的进一步发展提供了有益的探索。该工作在国际期刊ACS Nano上在线发表 (Engineering supramolecular nanomedicine for targeted near infrared-triggered mitochondrial dysfunction to potentiate Cisplatin for efficient chemophototherapy. ACS Nano 2021,https://doi.org/10.1021/acsnano.1c09555),ACS Nano为顶级学术期刊,目前其影响因子为15.881。天然药物与免疫工程重点实验室硕士研究生杜相甫为共同第一作者,河南大学特聘教授赵美霞为第一通讯作者。
(全文链接:https://pubs.acs.org/doi/abs/10.1021/acsnano.1c09555)
上述研究工作得到了国家自然科学基金、河南省高校科技创新人才支持计划等项目的经费支持。这些成果推动了我校医学、生物与其他学科的交叉融合发展。
赵美霞,博士,教授,博士生导师,河南大学特聘教授,河南省高校科技创新人才,河南省教育厅学术技术带头人,河南省高等学校青年骨干教师,河南省优秀毕业研究生指导教师,美国华盛顿大学国家公派访学者,广东省优秀博士学位论文获得者。主要从事纳米药物载体及荧光探针和抗肿瘤药物的设计合成及其抗肿瘤活性研究。主持国家自然科学基金2项,省级项目8项。以第一或通讯作者在ACS Nano,Biomaterials等国际著名期刊发表论文30多篇,授权中国发明专利4项,研究成果获得较高的学术评价,多篇文章被评为封面或封底论文及热点文章。获得河南省自然科学学术奖一等奖等多项奖项。